原电池的工作原理
原电池是把化学能转化为电能的装置,那么化学能的本质是什么?化学能是键能吗?
化学能可粗略看作是一种势能。比如,我们通常说某物质稳定,其实是因为该物质具有的化学能相对较低(物理学里讲,势能低的物体比较稳定),而活泼物质具有的化学能则较高。
有人认为化学能主要储存在化学键里,比如生物学里提到的所谓“高能磷酸键”,当该键破坏时,会释放出大量的能量。
其实,这种认识只是粗略的、宏观的。
从微观层面看,破坏任何化学键都要吸收能量,而非放出能量。
之所以说高能破坏磷酸键的过程中释放能量,是因为该键断开吸收的能量较少,而在断键的同时伴随着新化学键的形成则释放大量的能量,宏观结果是释放能量而已。
根据以上分析可知,化学能跟键能有关,但化学能并非键能。
恰恰相反,化学键的键能越大,对应物质越稳定,物质所含有的化学能越低。
2. 为什么形成电池后,氧化还原反应的速率会大幅度上升呢?
让我们以Zn + 2H+ = Zn2++ H2↑反应为例,从微观角度研究一下。
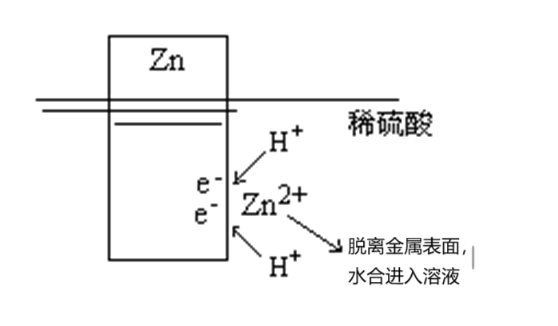
先来看锌片直接插入酸溶液的情况:从微观层面看,Zn置换H2的过程可分解为2个步骤。
首先,在水分子的作用下,Zn2+把电子留在锌片表面上,自身进入水溶液形成水合锌离子。这是金属的离子化过程。
任何金属在水中都存在此离子化过程,只是不同金属的离子化趋势大小不同,其趋势大小可用电极电势表示。
然后,溶液里的H+ 在锌片表面上获得电子形成H2 被还原[图1]。
图1 锌与酸反应的微观过程示意图
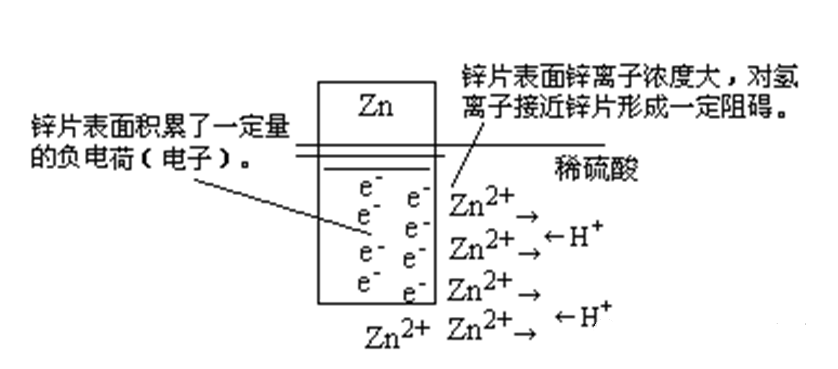
可是,Zn2+毕竟带有正电荷,它与锌片表面的电子存在天然的吸引力。
因此,锌片的附近Zn2+浓度较大。而H+也是带正电荷的,锌表面的Zn2+会对H+具有同性排斥作用,这就对H+ 接近锌片形成一定的阻碍作用[图2]。
可以想象,在锌片的表面附近,Zn2+、H+ 像节日里大型超市熙熙攘攘购物的人群一样,相互之间“你来我往”地“挤来挤去”,导致整体上置换反应的速率不够大。
图2锌与酸反应的微观过程示意图
造成这一现象的根本原因在于锌片表面积累的电子对锌离子的“牵扯作用”。
物理学常识告诉我们:
电子有沿着导体分布的性质。
如果我们用导线把锌片与插入同一溶液的铜片(或者其它不如Zn活泼的导电体,如石墨棒)连接,情况会怎样呢?
锌片表面的电子就会按照物理学规律自发地分布到铜片的表面上(形成电流),这时铜片上就有了多余的电子,而铜片表面没有像锌片附近那么多的Zn2+排斥H+,于是溶液里的H+就可以顺利地在铜片表面获得电子还原为H2。
H+ 在铜片表面顺利地获得电子,必然导致铜片表面电子密度降低,这时锌片上的电子就会通过导线源源不断地流向铜片,形成电流。
同时:
反应的秩序性大为增强,于是反应速率随之大幅度上升。
这既是钢铁制品在电解质溶液里容易发生电化学腐蚀的本质,也是为什么一般使用粗锌跟酸作用制取H2而不是用纯锌的原因。
3. Zn-Cu-H2SO4电池中,如果说H+向正极移动是为了去获得电子还原,那么SO42-向负极移动的动力是什么?
静电吸引力。因为负极上金属锌在不断发生离子化,锌片附近积累了过多带有正电荷的Zn2+,它们对于溶液里带负电荷的SO42-具有经典引力作用。
4. 正极、负极,阴极、阳极之间的关系究竟是怎样的?为什么在“牺牲阳极的阴极保护法”里把负极叫做阳极?
正极、负极是物理学关于直流电源两极给出的定义。正极、负极的说法一般不用于电解池。
正极:电流流出的极,或者说电子流入的极。据此,Zn-Cu-H2SO4电池里,Cu电极为正极。
负极:电流流入的极,或者说电子流出的极。Zn-Cu-H2SO4电池里Zn为负极。
阴极、阳极是化学对原电池、电解池里的电极给出的统一定义。
阳极:指发生氧化反应的极。
在Zn-Cu-H2SO4电池里,Zn电极失去电子发生氧化反应,故为阳极。
阴极:指发生还原反应的极。
Zn-Cu-H2SO4电池里,铜电极表面发生H+得电子还原反应,故为阴极。
如果在电解池中,则连接外电源正极的极,需要不断输送电子给电源正极,故必须发生氧化反应,此为阳极;而与电源负极连接的极则获得电子发生还原反应,为阴极。
明确了“正极、负极”为物理学规定的,而“阴极、阳极”为化学里的定义,它们之间的关系也就搞清楚了。